| У електрохемијским генераторима (или електрохемијским изворима) се хејмиска енергија претвара у електричну. У њима молекули више енергије прелазе у молекуле ниже енергије, а разлика ових енергија се ослобађа у облику електричне енергије. Постоје две врсте електрохемијских генератора:примарни и секундарни. Примарни електрохемијски генератори се после једне употребе бацају; (Лекланшеов елемент – обична батерија). Секундарни електрохемијски генератори се после пражњења могу више пута поново пунити и празнити; (оловни акумулатор ) Један основни електрохемијски елемент се назива ћелија (један Лекланшеов чланак који има напон од1,5V). Више ћелија везаних редно чине батерију (на пример, батерија за ручну батеријску светиљку има 3 ћелије од 1,5V што укупно износи 4,5V ). Примарни извори:- Најчешће употребљавана примарна ћелија је Лекланшеов елемент. Његов пресек је приказан на слици (1). 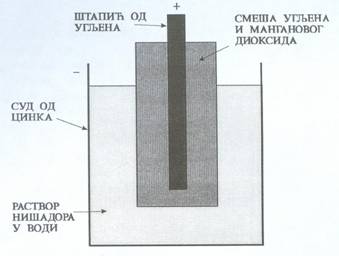
Има две електроде уроњене у електролит. Једна електрода је суд од цинка (Zn) и она је негативна. Друга електрода је од манган диоксида и позитивна је. Манган диоксид је у облику праха, па је помешан са гарфитом, који у овом случају чини проводник. У овој смеши манган диоксида са гарфитом налази се угљени штапић који служи као прикључак. Електролит је водени раствор нишадора. Приликом пражњења се троши електрода од цинка, па се може десити да електролит процури. Уколико Лекланшеов елемент дуго стоји неупотребљен (од 3 месеца до 1 године) може да дође до његовог самопражњења и тада такође електролит може да процури. Напон једне ћелије је око 1,5V. Неки произвођачи Лекланшеових батерија ставњају око ње суд од челика, па истрошена батерија не може да исцури и тако оштети електронски уређај укоме се налази. Ове батерије обично носе ознаку super dru (супер суве). Алкалне батерије.- Поред Лекланшеових елемената често се употребњавају и алкалне батерије. Пресек једне алкалне ћелије је приказан на слици (2). 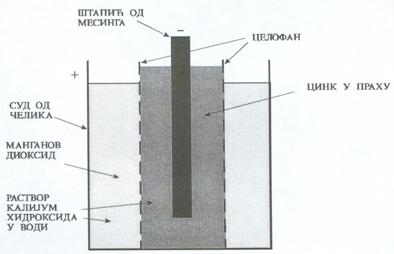
Електролит је водени раствор калијум хидроксида, који не учествује у хемијским реакцијама, него само служи да електролит буде проводан. После једне године ћелија садржи још око 90 % електроцитета и сама се испразни за око 3 године.Напон једне ћелије је такође око 1,5V. Секундарни извори. – Секундарни извори се могу пунити и празнити и обично се називају акумулатори. Пресек оловног акумулатора је приказан на слици 3. 
Позитивна електрода је од оловног оксида, а негативна од чистог олова . Електроде се праве у облику решеткастих плоча да би им површина била што већа. Електролит је 40-процентни раствор сумпорне киселине. Хемијски проценат је реверзибилан (акумулатор може да се пуни и празни). Напон једне ћелије је око 2,1 V. Оловни акумулатор се не сме оставити испражњен јер се неповратно сулфатизују плоче. Други често употребљавани акумулатори су челични. Напон једне ћелијеје око 1,2 V. Ова врста акумулатора има велику количину електроцитета у односу на масу, па се употребљава тамо где је потребно да буду што лаганији (на пример, за рударске лампе). Доста је скуп, те се користи за важније уређаје (на пример, доста се користи у железничким вагонима за осветљење).
|





